#HacemosFuturo, #OrgulloUNSAM, Escuela de Bio y Nanotecnología (EByN), home
Luego de casi cuatro años de trabajo intensivo, la primera vacuna 100 % argentina fue aprobada por la ANMAT para su producción y comercialización. Más de 600 científicxs y profesionales, 24 instituciones y casi 2 mil voluntarixs de todo el país fueron parte de este desarrollo liderado por la UNSAM, el CONICET y el Laboratorio Cassará, que tejieron una extensa red público-privada para hacer frente al SARS-CoV-2 y sus futuras mutaciones. La nueva fórmula, segura y eficaz como refuerzo contra el COVID-19, será escalada por un total de 5 millones de dosis al año y podrá exportarse como producto innovador.
“Descansamos un día a la semana y, entre todos, cubrimos los siete días. Tratamos de no frenar el proceso. Cuando se puede, hacemos algunas reuniones por Zoom. Somos dos varones y diez mujeres, de las cuales siete somos madres. Mis hijas tienen trece y dieciséis, se la bancan adentro, pero para las que tienen hijos más chicos es complicado”, contaba Juliana Cassataro, especialista en inmunología, enfermedades infecciosas y desarrollo de vacunas de nuestra Escuela de Bio y Nanotecnologías (EByN), en agosto de 2020, cuando el proyecto de desarrollo de una vacuna local que pudiera hacer frente al huracán pandémico daba sus primeros pasos por los caminos de un Campus “como abandonado del mundo”.
Eran días difíciles para todxs: la cuarentena obligaba a la población global a permancer confinada, mientras un millar de héroes y heroínas anónimxs mantenía a flote la esperanza colectiva trabajando en hospitales atestados o en laboratorios desiertos. Una de ellxs era Cassataro, que al igual que otrxs siete millones de científicxs del mundo, de un día para otro tuvo que reorientar su rutina científica hacia un único objetivo: desarrollar la primera vacuna contra el COVID-19 en tiempo récord y con los recursos que, en ese momento, solo podía ofrecerle una universidad pública al borde de la General Paz.
“Aunque seguramente habrá otra vacuna antes que la nuestra, quedaremos capacitados para la próxima pandemia”, decía Cassataro, convencida por entonces de que los esfuerzos de su equipo valdrían la pena, incluso compitiendo con proyectos que ya estaban por iniciar la Fase 3 de los ensayos clínicos, aunque sin evaluar detalles de seguridad y eficacia. “En un mundo con una minoritaria pero intensa campaña antivacunas hay que tener un fuerte compromiso. Esto para mí es fundamental, no quisiera que nuestra vacuna se hiciera en dos meses. Vamos a evaluarla durante el tiempo que se tenga que evaluar, con los tiempos que corresponden”.
Desde aquel momento hasta hoy pasaron poco más de tres años y la vacuna, desarrollada finalmente por la UNSAM, el CONICET y el Laboratorio Pablo Cassará con el apoyo del Ministerio de Ciencia, Tecnología e Innovación y la Agencia I+D+i, muy pronto estará disponible en los vacunatorios de todo el país.
Bautizada en honor a la primera mujer médica de la Argentina, la ARVAC Cecilia Grierson es una vacuna de segunda generación basada en una tecnología muy segura y conocida: la proteína recombinante, que se utiliza desde hace décadas para fabricar la vacuna contra la Hepatitis B —que se aplica en niñxs recién nacidxs— y contra el HPV —que se aplica en adolescentes—.
La noticia es un nuevo hito de la ciencia y la tecnología nacional: desde los laboratorios de investigación de una universidad pública hasta el sistema inmune de más de 2 mil voluntarixs de toda la Argentina, ARVAC es la primera vacuna desarrollada íntegramente en el país que completó todas las etapas de desarrollo, tiene baja reactogenicidad (efectos adversos muy leves) y un alto factor de seroconversión (induce un aumento de anticuerpos de entre 10 y 16 veces en el 90 % de lxs vacunadxs).
¡Conocé esta historia de heroismo colectivo gestada en una universidad #PúblicayGratuita!
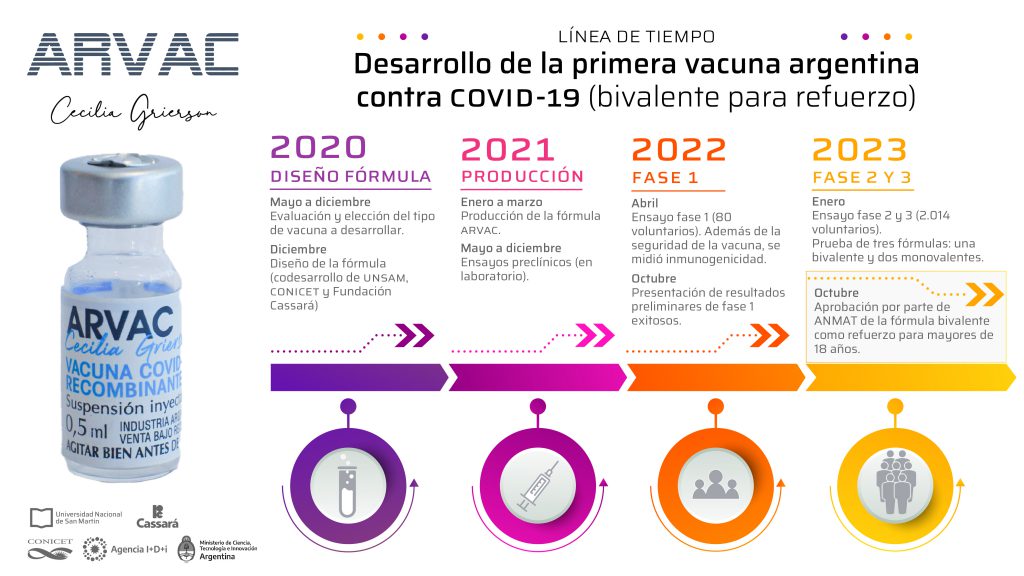
Entre mayo y noviembre, el equipo dirigido por Juliana Cassataro e integrado por Karina Pasquevich, Lorena Coria, Diego Álvarez, María Laura Darriba, Lucas Saposnik, Celeste Pueblas Castro, Eliana Castro, Claudia Filomatori, Eugenia Bardossy, Laura Bruno y Lucía Chemes evalúa y elige el tipo de vacuna a desarrollar. El diseño de la fórmula definitiva —codesarrollada por la UNSAM, el CONICET y la Fundación Cassará— se concreta en diciembre.
Entre enero y marzo, el consorcio público-privado integrado por biólogxs, bioquímicxs, virólogxs, biotecnólogxs y microbiólogxs produce la fórmula proteica recombinante y, poco después, da inicio a los ensayos preclínicos en laboratorio, cuyas pruebas se extienden hasta diciembre con resultados exitosos.
El Gobierno nacional anuncia en marzo la aprobación del suero por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y el inicio de la Fase 1. El Ministro de Ciencia, Tecnología e Innovación, Daniel Filmus, y su par de Salud, Carla Vizzotti, comunican el inicio de los ensayos clínicos de seguridad en personas y declaran: “Es un orgullo para la ciencia argentina disponer de una vacuna nacional hecha por nuestras científicas y científicos, y lo que significa llevar la investigación y el desarrollo al servicio de las personas”. Los ensayos clínicos de Fase 1 se realizan en abril sobre una muestra de 80 voluntarixs de entre 18 y 60 años. Además de la seguridad de la vacuna, se mide su tolerabilidad e inmunogenicidad.
En octubre se presentan los resultados de esta primera fase, los cuales muestran que ARVAC es segura y muy inmunogénica, pues induce aumentos de hasta 30 veces en el título de anticuerpos neutralizantes contra el virus. Esos resultados, más otras características de la vacuna —estable en heladera, adaptable a otras variantes que circulan en la región y de producción local—, la posicionan como la candidata ideal para dosis de refuerzo en Argentina y en la región a partir de 2023. “Observamos muy buenos niveles de respuesta respecto de la capacidad neutralizante de los anticuerpos contra diferentes variantes del nuevo coronavirus incluyendo Omicrón. De acuerdo a los resultados, la presunción es que la vacuna ARVAC CG va a andar muy bien”, celebra Jorge Geffner, investigador del CONICET en el Instituto de Investigaciones Biomédicas en Retrovirus y SIDA (INBIRS, CONICET-UBA) a cargo de los ensayos de neutralización.
Tras una nueva autorización de la ANMAT, en febrero el Gobierno nacional anuncia el inicio de los ensayos de la segunda y tercera fase, a ser implementados en 10 centros de todo el país. Esta etapa cuenta con un financiamiento de 1.100 millones de pesos por parte de la Agencia I+D+i, dependiente del Ministerio de Ciencia y Tecnología.
En marzo se lleva a cabo un anuncio institucional en el Auditorio Tanque del Campus Miguelete con la participación de la ministra de Salud, Carla Vizzoti; el ministro de Ciencia, Daniel Filmus; el presidente de la Agencia I+D+i, Fernando Peirano; el rector de la UNSAM, Carlos Greco; el líder de la fase 3 de la prueba clínica, Gonzalo Pérez Marc; y la investigadora a cargo del proyecto, Juliana Cassataro. “Todas las investigaciones muestran que habrá que efectuar campañas de vacunación de refuerzo todos los años —en algunos casos, varias veces al año—, y Argentina será el primer país de América del Sur en tener esta vacunación con desarrollo propio que significó años de investigación básica”, destaca Filmus.
En esta etapa, para evaluar la seguridad e inmunogenicidad de 3 fórmulas ARVAC —una bivalente y dos monovalentes— se convoca a casi 2 mil voluntarixs de todo el país, quienes comparten sus motivaciones y experiencias en distintos medios. Al mismo tiempo, los resultados de la Fase 1 son publicados por la revista Nature Communications.
A un paso de culminar la Fase 3, la ministra Vizzotti asegura: “Están avanzando de manera concreta y fuerte, tanto en el ensayo como en los resultados. Ahora es importante tomar esta iniciativa como el primer paso hacia una política de largo plazo que permita dejar una hoja de ruta para seguir creciendo y continuar con otros proyectos”.
El 17de octubre de 2023 la ANMAT aprueba la fórmula bivalente como vacuna de refuerzo para mayores de 18 años. El logro se anunció el miércoles 18 de octubre en el Polo Científico Tecnológico (CABA), y en el Congreso Mundial de Vacunas, que se desarrolló en Barcelona (España).
Además de funcionar como refuerzo contra el COVID-19 en la Argentina, la nueva vacuna ARVAC Cecilia Grierson —única en América del Sur— será también un producto innovador de exportación para la región y el mundo.
Más info, en esta nota.
La ANMAT aprobó el uso de ARVAC, la vacuna argentina de refuerzo contra el COVID-19
Se trata de la vacuna ARVAC Cecilia Grierson, que demostró ser segura y eficaz como refuerzo contra el COVID-19 en mayores de 18 años. El desarrollo fue liderado por la Universidad Nacional de San Martín, el CONICET y el Laboratorio Cassará, que conformaron una red público-privada con más de 600 científicxs y profesionales pertenecientes a 24 instituciones del país. La vacuna ya se produce en la planta de Cassará en la Ciudad de Buenos Aires y puede adaptarse en cuatro meses a nuevas variantes de SARS-CoV-2 circulantes en la región. Es un hito para la historia de la ciencia y de la tecnología Argentina.
Por Alejandro Zamponi. Foto: Leandro Martínez
La ANMAT autorizó mediante la disposición N.º 2023-8604 el registro de la vacuna ARVAC Cecilia Grierson versión bivalente contra SARS-CoV-2, la cual podrá ser aplicada en territorio argentino como vacuna de refuerzo en mayores de 18 años. La noticia es el resultado de cuatro años de trabajo de una red que aglutina a más de 600 científicxs y profesionales pertenecientes a 24 instituciones públicas y privadas. Esta red fue liderada por la Universidad Nacional de San Martín, el CONICET y el Laboratorio Pablo Cassará con el apoyo del Ministerio de Ciencia y la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación (Agencia I+D+i).
La noticia es un nuevo hito de la ciencia y de la tecnología argentina: ARVAC es la primera vacuna que completa todas las etapas de desarrollo, desde las mesadas de investigación de una universidad pública, la producción biotecnológica industrial y la investigación clínica, hasta la autorización de registro por parte de la ANMAT.
ARVAC es una vacuna proteica bivalente diseñada para ser usada como refuerzo. Se basa en la tecnología de proteína recombinante, una tecnología muy segura y conocida que se utiliza desde hace tres décadas para fabricar la vacuna contra la Hepatitis B, que se utiliza en niños recién nacidos, o contra el HPV, que se aplica a adolescentes.
ARVAC se puede almacenar y transportar refrigerada (2 – 8 °C), lo que representa una gran ventaja en términos logísticos respecto a las vacunas alternativas en base a ARN mensajero que requieren almacenarse congeladas a -70°C.
Además, ARVAC fue diseñada para que su principio activo pueda actualizarse en cuatro meses para hacer frente a nuevas variantes del virus que escapen a la respuesta inmunológica de la población. Al ser producida en el país garantiza la respuesta más veloz frente a una nueva emergencia.
En los ensayos de fase II/III se probaron tres fórmulas de la vacuna: dos monovalentes y una bivalente. Las tres demostraron ser seguras y eficaces en 2.014 voluntarios. Actualmente ANMAT autorizó el registro de la versión bivalente para mayores de 18 años, pero en un futuro podría autorizar también las otras versiones monovalentes.
Los resultados demuestran que las tres versiones de vacuna son seguras y con baja reactogenicidad (efectos adversos reportados muy leves). El indicador de que ARVAC indujo una mayor protección es el factor de seroconversión, que alcanzó un 90 % en el caso de la versión bivalente. Cabe destacar que el aumento en la cantidad de anticuerpos fue de entre 10 y 16 veces mayor que antes de aplicar la vacuna.
Una novedad de ARVAC bivalente es que, al reemplazar el antígeno Wuhan por el antígeno Gamma, evita el problema del pecado original inmunológico que se presenta en las actuales vacunas bivalentes. Esto fue demostrado en el estudio clínico de Fase II/III, en el que la versión ARVAC bivalente Gamma+Omicron generó un mayor aumento de anticuerpos neutralizantes contra Omicron respecto de la versión ARVAC monovalente Omicron.
Estos resultados ya presentados ante la ANMAT también serán publicados en una revista científica de máximo nivel, tal como se hizo con los resultados de la fase I, que fueron publicados en la revista Nature Communications.
Financiamiento y producción
ARVAC es un proyecto público-privado que combina la capacidad de investigación del sistema científico-tecnológico argentino con el desarrollo tecnológico-industrial en el campo de la biotecnología de una empresa farmacéutica de capitales nacionales.
Los estudios preclínicos fueron financiados por la AgenciaAgencia I+D+i), dependiente del Ministerio de Ciencia, Tecnología e Innovación, mientras que el desarrollo y el escalado industrial del proceso biotecnológico bajo estándares de calidad GMP, así como el estudio clínico de Fase I, fueron financiados por el Laboratorio Cassará. Los ensayos de fase II/III fueron financiados por la Agencia I+D+i, mientras que la producción de un primer lote de la vacuna a riesgo corrió a cargo de Cassará.
El laboratorio Cassará tiene la capacidad de producir el principio activo, formular y envasar la vacuna en sus plantas habilitadas ya en funcionamiento en nuestro país. La capacidad de producción instalada permitirá no sólo abastecer la demanda del Ministerio de Salud que será pagada localmente en pesos argentinos, sino también exportar el excedente a la región generando ingreso de divisas al país.
Más info, en esta nota.
La red público-privada que hizo historia
- Instituto de Investigaciones Biotecnológicas de la Escuela de Bio y Nanotecnologías de la UNSAM
- CONICET
- Laboratorio Pablo Cassará
- Fundación Pablo Cassará
- Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación (Agencia I+D+i)
- Ministerio de Ciencia, Tecnología e Innovación de la Nación
- Ministerio de Salud de la Nación
- Ministerio de Salud de la Nación de la Provincia de Buenos Aires
- Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT)
- Instituto de Investigaciones Biomédicas en Retrovirus y SIDA (INBIRS), Universidad de Buenos Aires-CONICET
- Centro de Medicina Comparada, Universidad Nacional del Litoral (Santa Fe)
- Nobeltri (CABA)
- Fundación Huésped (CABA)
- Gonzalo Pérez Marc y equipo, líder de la Fase 3
- Instituto Universitario CEMIC (CABA)
- FP Clinical Pharma (CABA)
- Instituto de Investigaciones Clínicas (Mar del Plata)
- Clínica del Niño y la Familia (Mar del Plata)
- Instituto Médico Platense (La Plata)
- Clínica Privada del Sol (Córdoba)
- Centro de Investigaciones Clínicas Salta (Salta)
- Centro de Investigaciones Clínicas Belgrano (CABA)
- Vacunar (CABA)
- Investigación Clínica Aplicada SRL (CABA)
anticuerpos, arvac, biotecnología, ciencia y tecnología argentina, contra COVID-19, coronavirus, destacada, ensayos clínicos, Escuela de Bio y Nanotecnología, industria argentina, Innovación y Transferencia Tecnológica, pandemia, soberanía sanitaria, suero, vacuna argentina
Cuánta alegría chicas!!!!! Gracias por tanto esfuerzo personal y gracias a la educación pública por tanto!!!!!
Excelente el trabajo del equipo de Juliana Cassataro, el apoyo brindado por el Estado para tener la vacuna y disponer de eso conocimiento y andamiaje institucional para su producción. Esperaré a que esté disponible para darme la nueva dosis.
Orgullo argentino!! Ojalá esté disponible en vacunatorios más que prontamente y en cantidad suficiente. Muchos la estamos esperando!!!!!! Y a seguir este camino, que nada los detenga!!!
Felicitaciones!! Orgullo Argentino!!! Está noticia debería tratarse y ser nota en todos los medios de comunicación por su valor y no que por lo gral. hablan de choluleses durante todo el día
Orgullosísimo de nuestro país. Felicitaciones a nuestros científicos/as por hacer posible que nuestra vacuna sea realidad
Felicitaciones a todos los equipos que trabajaron en el desarrollo y producción de la Arvac
Orgullo Argentino!